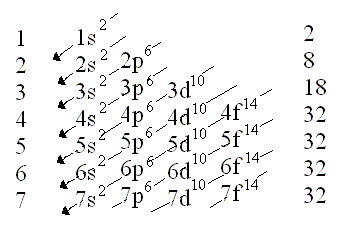- Si l'àtom no es neutre és un IÓ, i poden tenir-- càrrega postiva (cations) i perd electrons
--càrrega negativa (anions) i guanya electrons
- La distribució dels electrons dins de l'escorça és la CONFIGURACIÓ ELECTRÒNICA.
- A aquesta imatge es veu un esquema on explica le regla de les diagonals i s'acomença des de dalt seguint les fletxes:
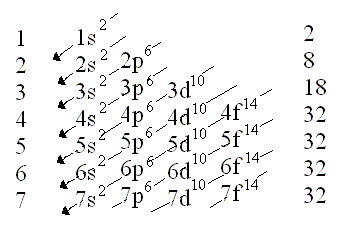
-L'ordre en horitzontal és;
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f,6d,7p
-A cada lletra li correapon un número al qual tindran que elevar-se:
s=2 d=10
p=6 f=14
-Alguns exemples que hem fet a classe són:
- Ca= 1s2, 2s2,2p6, 3s2, 3p6, 4s2
- Mo= 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10
- Ga= 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p1
- Se= 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p4